

- 吡咯烷酮羧酸钠 L-吡咯烷
- 水性油墨中,加入蜡乳液与
- 农药原料中常用的三氯乙酸
- 分散剂在涂料中的八大作用
- 二氯乙酸是怎么制成的?二
- 水性涂料选择分散剂该注意
- 一篇文章让你读懂什么是氯
- 抗静电剂在涂料工业中的应
- 什么是过乙酸?过乙酸的用
- 知道增稠剂与流平剂之间的
- 一文了解乙酸酐在不同行业
- ”硬脂酸、PE蜡和石蜡“在
- 一文读懂冰乙酸!冰乙酸的
- 膨润土改性及其在环境治理
- 橡塑行业常用的溶剂,乙酸
- 工业防锈水性防锈剂研究与
- 甲酸在印染工业中的应用,
- 乳化剂np10的性能与应用
- 钨酸的作用?钨酸的性质及
- 一文读懂消光粉的三大用途
- 皮肤碰到氟硅酸了怎么办?
- 关于硅酸你了解多少?硅酸
- 神奇!氯磺酸的作用范围竟
- 胶粘剂行业竞争激烈,水性
- 高氯酸你了解多少?高氯酸
- 偶联剂和交联剂、相容剂在
- 氢溴酸的性能及用途介绍
- 无水氢氟酸有什么作用?无
- 氢氟酸你了解多少?氢氟酸
- 消泡剂在混凝土中的应用
维甲酸和L-抗坏血酸-2-磷酸三钠盐在体细胞重编程过程中的相互...
摘要:维甲酸(RA)和L-抗坏血酸-2-磷酸三钠盐(AscPNa)虽然都能促进诱导小鼠胚胎成纤维细胞(MEF)为诱导多能干细胞(iPS),但在共存的情况下两者的诱导能力反而下降。来自中国科学院广州生物医药与健康研究院的郑辉团队提出了如下假设,即RA和AscPNa可能共享部分下游信号通路,导致相互“掣肘”。他们的研究通过RNA-seq证实重编程过程中RA与AscPNa的下游激活基因高度重合。此外,RA能够通过调节Glut1/3,有助于L-抗坏血酸膜(Asc)转移,促进并维持其在胞内长期高水平的氧化状态,另一方面,AscPNa主要在促进MET的过程中,下调Zeb1和Twist1,进而抑制Cyp26a1/b1的表达,从而维持胞内RA的水平。两者在体细胞重编程中的能力和功能存在不同。此项研究给出的结论为在诱导重编程过程中RA和AscPNa(维他命A与C)之间存在着某种正反馈效应。具体结果如下。
作者发现只要有AscPNa,MEF细胞在不同培养基的培养条件下12天左右均能出现Oct4的阳性克隆,然而AscPNa却能够抑制RA的诱导效率(图1B-D)。接下来,作者对用N2B27培养基培养6天的诱导重编程细胞进行RNA-seq。从差异基因中鉴定出受RA与AscPNa调控的重合基因。上调的基因主要与细胞周期、神经发生、细胞粘附有关;下调的基因与胞外基质、细胞迁移和趋化作用有关(图1E-H)。
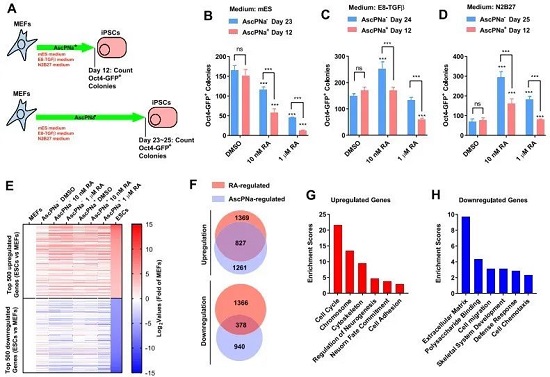
作者猜测有可能的一种解释是RA和AscPNa在参与Asc的合成和降解过程中产生了冲突,于是顺藤摸瓜找到了SVCT和GLUT家族,因为它们发挥转运和维持Asc的作用。结果显示RA诱导的重编程过程中第6天Glut1和Glut3启动子区域的RARA元件被激活,表达升高,对应的Asc在胞内水平也在增加(图2A-D)。接下来,作者测试了MEF细胞在药物诱导早期中,AscPNa对Glut1和Glut3的影响(同时也用了脱氢抗坏血酸DHAA进行比较,但发现DHAA不如AscPNa稳定),结果显示RA能维持诱导初期胞内Asc的水平,并防止后期胞内Asc出现下降(图2E-N)。总而言之,RA有助于维持胞内Asc水平。

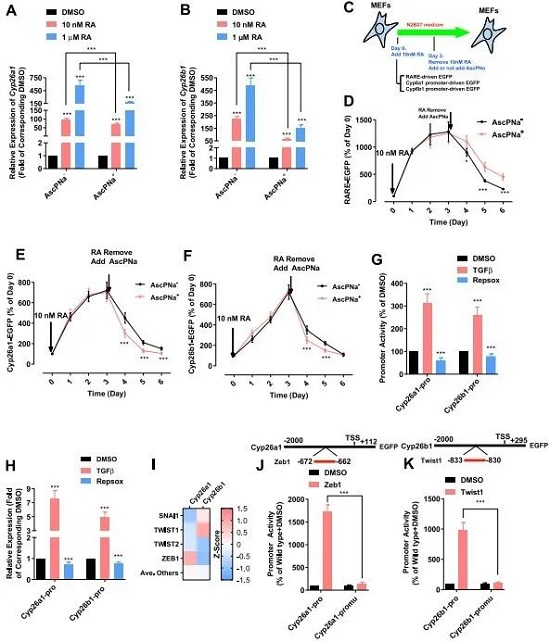
反过来,AscPNa对RA的影响是什么呢?同样的思路,RA在体内被CYP26A1和CYP26B1降解。现在AscPNa作用下,这两个酶被抑制了(图3A-B)。然后作者构建了一个含三个RARA元件加TK启动子介导的GFP报告质粒,转染进MEF细胞,当RA处理时,GFP就会表达,撤掉RA,GFP表达就会逐渐下降。而撤掉RA的同时加入AscPNa,GFP仍然有表达(图3C-D),换成CYP26A1和CYP26B1的启动子,也是同样道理(图3E-F)。接下来作者想到可能是通过AscPNa调控的下游某个转录因子能结合这些启动子来发挥作用的,作者从EMT的角度入手,用TGF-β和TGF-β的抑制剂同样达到了CYP26A1和CYP26B1转录的调控效果(图3G-H),那作者顺藤摸瓜地想到了EMT中M状态比较重要的一些转录因子,如ZEB1、TWIST1等,通过Pscan软件预测到它们确实能与CYP26A1和CYP26B1启动子相结合,并得到了验证(图3I-K)。这里得出的结论,AscP东曹哑光粉Na通过诱导MET从而抑制CYP26A1和CYP26B1表达,进而引起RA在胞中的积累。
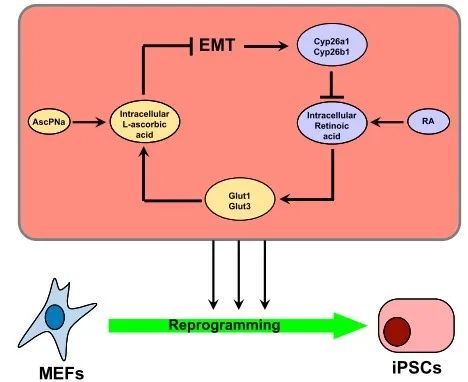
最后作者总结如下,在iPS诱导的重编程过程中,RA上调Glut1、Glut3等,维持胞内高水平的Asc,进而促进重编程;而AscPNa引起MET发生,从而抑制CYP26A1和CYP26B1表达,最终破坏RA的降解。这种调控机制在其他细胞和生物学行为中均是保守的,所以这个分子机制具有拜耳固化剂重要意义。

【版权声明】秉承互联网开放、包容的精神,凯茵化工欢迎各方(自)媒体、机构转载、引用我们原创内容,但要注明来源凯茵化工;同时,我们倡导尊重与保护知识产权,如发现本站文章存在版权问题,请将版权疑问、授权证明、版权证明、联系方式等,发邮件至 app@shkingchem.com,我们将第一时间核实、处理,感谢您的配合。
相关产品
【版权声明】秉承互联网开放、包容的精神,凯茵化工欢迎各方(自)媒体、机构转载、引用我们原创内容,但要注明来源凯茵化工;同时,我们倡导尊重与保护知识产权,如发现本站文章存在版权问题,请将版权疑问、授权证明、版权证明、联系方式等,发邮件至 app@shkingchem.com,我们将第一时间核实、处理,感谢您的配合。










