

- 吡咯烷酮羧酸钠 L-吡咯烷
- 水性油墨中,加入蜡乳液与
- 农药原料中常用的三氯乙酸
- 分散剂在涂料中的八大作用
- 二氯乙酸是怎么制成的?二
- 水性涂料选择分散剂该注意
- 一篇文章让你读懂什么是氯
- 抗静电剂在涂料工业中的应
- 什么是过乙酸?过乙酸的用
- 知道增稠剂与流平剂之间的
- 一文了解乙酸酐在不同行业
- ”硬脂酸、PE蜡和石蜡“在
- 一文读懂冰乙酸!冰乙酸的
- 膨润土改性及其在环境治理
- 橡塑行业常用的溶剂,乙酸
- 工业防锈水性防锈剂研究与
- 甲酸在印染工业中的应用,
- 乳化剂np10的性能与应用
- 钨酸的作用?钨酸的性质及
- 一文读懂消光粉的三大用途
- 皮肤碰到氟硅酸了怎么办?
- 关于硅酸你了解多少?硅酸
- 神奇!氯磺酸的作用范围竟
- 胶粘剂行业竞争激烈,水性
- 高氯酸你了解多少?高氯酸
- 偶联剂和交联剂、相容剂在
- 氢溴酸的性能及用途介绍
- 无水氢氟酸有什么作用?无
- 氢氟酸你了解多少?氢氟酸
- 消泡剂在混凝土中的应用
PH标准缓冲溶液的制备方法
概述[1]
PH标准缓冲溶液是一种在一定程度上可保持其pH硅烷偶联剂值不变的溶液。如果向溶液中加入少量的酸或碱,或溶液中的化学反应产生了少量酸或碱,或将溶液稍加稀释,溶液的酸度能基本上稳定不变。
PH标准缓冲溶液一般是由浓度较大的弱酸及其共轭碱(弱酸及其盐或弱碱及其盐)所组成。其之所以能起缓冲作用,是因为溶液中既有大量质子供应者,又含大量质子接受者,当有少量酸或碱进入介质时,通过平衡移动能使溶液的pH值基本上保持不变,当被稀释时,由于共轭酸碱对的浓度以同样程度降低,其离解度以同样程度增大,所以溶液的pH值也可以基本上不变。每一种缓冲溶液都只具有一定的缓冲能力,如果向溶液中加入酸碱过多,缓冲能力就要减弱,甚至失去缓冲作用。缓冲剂的浓度越大,溶液中共轭酸碱的浓度比接近1:1时,缓冲溶液的缓冲能力也就越大。缓冲溶液除在分析化学中广泛应用外,在自然界、生产上和科学研究中都非常重要。
分类[1]
分析化学中用到的PH标准缓冲溶液有两类:一类是用来控制溶液酸度;另一类是用来测量溶液pH值时当标准参照物用。
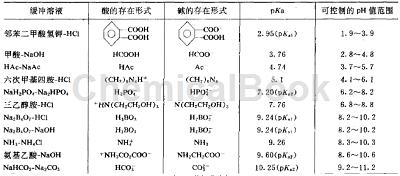
制备方法[2]
PH标准缓冲溶液配制:将配制溶液用到的药品CaCl2、NaCl、KCl、Na2SO4放置到烘箱中,在110℃下烘干1h,取出置于干燥器中冷却至室温;将TRIS置于干燥箱中,在室温条件下用五氧化二磷做脱水剂烘干。采用十万分之一精度的电子天平准确称取配制标准缓冲溶液所需的MgCl2、CaCl2、NaCl、KCl、Na2SO4、TRIS药品。称取MgCl243.8955g,用少量除氧水溶解,转移至100mL容量瓶中,用除氧水定容至100mL;称取CaCl211.0990g,用少量除氧水溶解,转移至100mL容量瓶中,用除氧水定容至100mL。
分别称取NaCl、KCl、Na2SO4各18.2333g、0.7455g、3.9771g,用少量除氧水溶解后,转移到1000mL容量瓶白碳黑中,然后用移液管加入MgCl2溶液25.00mL,CaCl2溶液10.00mL,HCl溶液(4.00mol/L)25.00mL,用除氧水定容至1000mL,此为混合溶液A。分别称取NaCl、KCl、Na2SO4各24.0773g、0.7455g、3.9771g,用少量除氧水溶解后,转移到1000mL容量瓶中,然后用移液管加入MgCl2溶液25.00mL,CaCl2溶液10.00mL,用除氧水定容至1000mL,此为混合溶液B。称取TRIS1.2114g,转移到1000mL聚乙烯瓶中,然后用移液管加入50.00mL混合溶液A,再加混合溶液B在电子天平上称重至1000.00g。此溶液即为pH标准缓冲溶液。
主要参考资料
[1] 中国成人教育百科全书·化学·化工
[2] CN201510043251.2一种海水pH标准缓冲溶液的配制方法

【版权声明】秉承互联网开放、包容的精神,凯茵化工欢迎各方(自)媒体、机构转载、引用我们原创内容,但要注明来源凯茵化工;同时,我们倡导尊重与保护知识产权,如发现本站文章存在版权问题,请将版权疑问、授权证明、版权证明、联系方式等,发邮件至 app@shkingchem.com,我们将第一时间核实、处理,感谢您的配合。
相关产品
【版权声明】秉承互联网开放、包容的精神,凯茵化工欢迎各方(自)媒体、机构转载、引用我们原创内容,但要注明来源凯茵化工;同时,我们倡导尊重与保护知识产权,如发现本站文章存在版权问题,请将版权疑问、授权证明、版权证明、联系方式等,发邮件至 app@shkingchem.com,我们将第一时间核实、处理,感谢您的配合。










